Survivin
Survivin es una proteína bifuncional que actúa como supresor de la apoptosis y también juega un papel central en la división celular. Es una proteína que se expresa en la mayoría de los cánceres y en algunos tiene significación pronóstica, relacionándose con la resistencia a antineoplásicos y a radioterapia. En base a éstos hallazgos se ha propuesto como diana de interés terapéutico. Varios estudios han demostrado que la inhibición de survivin reduce el crecimiento tumoral, incrementando la apoptosis y sensibilizando el tumor a diferentes agentes quimioterápicos. En la actualidad existen inhibidores de la survivin en desarrollo clínico (Carcinogenesis 2007)
Estructura y función de la survivin. El gen que genera ésta proteína se localiza en la posición telomérica del cromosoma 17. Survivin es una proteína de 16.5 kD de 142 aminoácidos. En la célula normal la función más importante tiene que ver con la regulación de los microtúbulos en la división celular en concreto con preservar la fidelidad genómica cuando los cromosomas viajan por el huso acromático en la división celular. De hecho la survivin interactúa con las proteínas del interior del centrómero, con la Aurora A y con la Borealin/Dasra B que son requeridas para formar el complejo del kinetokoro.
Otra función, no ciclo celular dependiente o independiente de la mitosis es su función en relación con los circuitos Wnt/Beta catenina, activación de citoquinas, activadora de la transcripción, coestimulante de mensajes y una serie de mecanismos de señales pleiotrópicas que están operativas durante el desarrollo y en las células cancerigenas y que explican la sobreexpresión de survivin en la mayoría de los cánceres.
Se conoce la interacción molecular de survivin con la proteína de choque térmico (Hsp90). Esta interacción es esencial para la estabilidad y función de survivin, de hecho los anticuerpos dirigidos a romper el complejo Hps90-Survivin en las células cancerigenas resultó en la degradación del proteasoma survivin y la apoptosis mitocondrial dependiente. Se ha sugerido también que survivin interviene en prolongar la vida celular cambiando la actividad telomerasa.
Apoptosis y survivin.
La homeostasis celular está regulada por el equilibrio entre las velocidades de proliferanción, diferenciación y muerte celular programada (apoptosis). En el cáncer éste equilibrio esta alterado debido a un aumento en la proliferación celular y una disminución de la apoptosis. Desde el punto de vista molecular estas alteraciones se adquieren por mutaciones de genes implicados en el control de estos procesos. Las células que adquieren estas mutaciones tienen ventaja y sus descendientes son seleccionadas. Los defectos en los mecanismos de apoptosis permiten a las células tumorales sobrevivir más allá de su vida fisiológica, obviar la necesidad de factores extracelulares para la supervivencia, obtener protección frente a la hipoxia y el estrés celular que provoca el tumor, dispone de más tiempo para acumular alteraciones genéticas, evitar que el sistema inmune elimine a las células tumorales y adquirir resistencia a la quimioterapia y a la radioterapia.
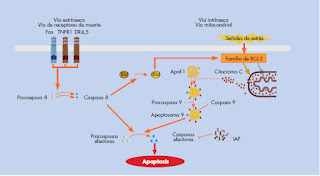
El mecanismo central de la apoptosis consiste en la activación de una familia de proteasas denominadas caspasas. Esta proteasas se activan jerárquicamente, de forma que las caspasas iniciadoras proteolizan y activa a las caspasas efectoras que a su vez proteolizan a otras proteínas, produciendo los cambios morfológicos y bioquímicos característicos de la apoptosis. La activación de las caspasas iniciadoras se produce esencialmente por dos vías:
- La vía de los receptores de la muerte o extrínseca
- La mitocondrial o intrínseca.
La vía extrínseca. Vía de los receptores de la muerte. Se inicia por la unión de ligandos extracelulares (como TNF-alfa, FasL o TRAIL) a sus receptores de la superficie celular (TNFR1, Fas, DR4 o DR5). Esta unión induce la activación de la caspasa 8, que a su vez actúa sobre las caspasas efectoras. Además, la caspasa 8 proteoliza a BID, y la forma proteolizada tBID es capaz de inducir la salida de factores mitocondriales proapoptóticos.
La vía intrínseca. Vía mitocondrial. Se desencadena como respuesta a una gran variedad de estímulos, internos o externos, y está regulada por proteínas de la familia de Bcl-2 que controlan la salida de algunas proteínas del espacio intermembrana mitocondrial al citosol. Una de ésta proteínas es el citocromo C, que una vez en el citosol se una a la proteína Apaf.1, induciendo su oligomerización junto a la caspasa 9 y la formación de un complejo heptamérico, el apotosoma, donde se activa la caspasa 9, que a su vez activa a las caspasas efectoras. Las proteínas de la familia Bcl.2 se asocian entre sí a través de sus dominios BH para formar homo y/o hetrocomplejos que tienen distintos papeles en el proceso de permeabilización de la membrana mitocondrial externa y la salida del citocromo C. Según el modelo más actual, las proteínas proapoptóticas BAX o BAK son esenciales para la salida del citocromo C. Las proteínas antiapoptóticas, como BCL-2 o BCL-Xt, inhiben a Bax/Bak. Finalmente, las proteínas proapoptóticas con un solo dominio BH3 inhiben a las proteínas antiapoptóticoas de la familia de BCL-2. La mayoría de estímulos apoptóticos no alteran los valores de proteína de BAX y BAK. La activación de Bax/Bak es mediada por la regulación de los miembros BH3, a través de mecanismos transcripcionales o postranscripcionales. Así, Puma es una diana transcripcional cuando la vía p53 se activa.
Fármacos en desarrollo que bloquean los inhibidores de la apoptosis. Survivin es un inhibidor de apoptosis. Su bloqueo activa la apoptosis. Hay fármacos en desarrollo con estudios fase II como el YM155. Una búsqueda en Clinicaltrial.gov nos da como resultado que con fecha en curso, hay 11 estudios con éste fármaco. Uno de esos estudios es el "LUCY" (A Study for the Treatment of Non-Small Cell Lung Cancer (NSCLC) in Patients Previously Treated With Chemotherapy). Es un estudio fase II con YM155 administrado por vía iv de forma continua durante 7 días.

No hay comentarios:
Publicar un comentario